細菌內毒素檢測平臺的驗證

驗證,這個詞在任何實驗室中都會引起一系列感覺,可能是恐懼感或不安感,因為驗證過程可能既費時又耗力。也可能引起興奮的感覺,因為實驗室中正引入一臺新儀器。無論何種感覺,驗證新平臺都是一項艱巨的任務。 為了確保成功進行驗證,必須完成并嚴格遵守幾個指南、原則和文件。儀器確認是監管審計中經常被引用的偏差,在進行驗證的過程中,收到警告信的可能性更大。如果偏差足夠嚴重,則可能會導致生產停工,并立刻發生成本高昂的錯誤。
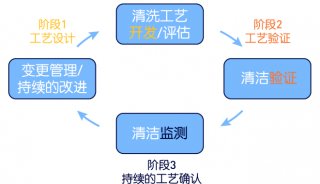
新的細菌內毒素檢測(BET)平臺的驗證可能包括遵循良好的自動化生產規范(GAMP)原則、美國藥典USP一般章節<1058>“分析儀器確認”指南以及關于設計確認(DQ)、安裝確認(IQ)、操作確認(OQ)和性能確認(PQ)的文件。雖然DQ通常由制造商完成,但一些實驗室可能會認為有必要自己為儀器完成這一確認。
為了確保正確驗證整個平臺,GAMP原則以及ALCOA+和21 CFR PART 11準則被用于補充USP <1058>,并幫助解決與軟件驗證有關的相關問題。不合規的最常見原因之一是由于儀器確認以及之后的軟件驗證可能會有不清楚的指南和術語。盡管使用了當前的資源和指南,想要完全實施新的或替代分析方法的實驗室,可能還需要完成USP <1225>“藥典方法驗證”或ICH Q2 (R1)“分析程序驗證”中概述的其他測試。
許多制造商會提供文件來完成新儀器和軟件的IQ、OQ和PQ測試,這對一些人來說是件好事;然而如果制造商提供的文件不符合公司質量管理體系中的要求,則會變成障礙。完成一個完整的IQ/OQ/PQ所需的工作范圍,特別是與更復雜的儀器有關的工作,可能導致一些用戶推遲實施新的平臺,直到有足夠的時間不受干擾地完成。實驗室團隊很少有足夠的時間自己完成系統驗證,所以除非專門指定某人來管理這個過程,否則幾個月過去了,新平臺和資格確認文件可能會被閑置。
平臺驗證完成后,可能需要創建或更新標準操作規程(SOP)。在將該平臺集成到實驗室以進行常規使用之前,需要執行此附加步驟。
內毒素檢測可使用各種不同儀器。在驗證時,每種平臺都會出現獨有的問題。一些帶有預存儲內毒素和鱟試劑的平臺可能偏離制造商使用說明(IFU,Instructions for Use),因為使用機器人平臺分析所有樣品所需的時間,需要將消耗品和樣品保持時間研究納入驗證過程。這將需要額外的資源,并在本已十分耗時的過程中額外增加幾天時間。
從提高QC實驗室效率的角度來看,引入更新的自動化平臺很有必要,但這些技術必須能及時驗證,以實現自動化的真正優勢。一些實驗室可能會質疑驗證機器人技術復雜動作所需的時間,或者他們可能需要一個專門的、成熟的工程師花費大量時間來驗證和維護儀器,可能還需要額外的測試案例來挑戰和確認軟件腳本及其功能。
在額外的穩固性測試中可以看到其他復雜情況。并非所有平臺都能解決難以處理的物質,因此很難證明其穩固性。這可能迫使一個實驗室擁有多個不同平臺,以滿足所有產品和水質檢測需求。更多的平臺意味著更多的驗證測試,更不用說更多的培訓、更多的消耗品和更多的設備維護。
如果分析方法本身存在其他問題,一些實驗室可能還需要進行驗證過程以外的測試。這些測試需要遵循USP <1225>和ICH Q2 (R1)中概述的準則,涉及到準確度、精密度、專屬性、定量限、線性、范圍、重現性和耐用性,并可能在任何一項驗證中增加好幾天的時間。
盡管對一個平臺的驗證過程可能很艱苦,但有些可用選項可以改進典型的驗證流程,使實驗室以所需的產能運作,而無須打斷或重新分配分析人員。簡化流程使QC實驗室可以在內部或在制造商的幫助下完成驗證。
憑借清晰、易遵循、全面的IQ/OQ/PQ文件,實驗室中幾乎任何人可以在幾天內對一個理想的平臺完成全面驗證。用戶知道儀器和軟件已完全符合法規要求并經過確認與驗證,并對其胸有成竹。如此強有力的確認過程可確保儀器和軟件即使在滿負荷運行時也能按設計運行。
此外,一個合格的、經過認證的廠商代表可以在現場進行驗證。這種選擇可以讓實驗室分析人員和管理人員專注于其他項目,將停機時間降到最低。一旦驗證完成,實驗室管理人員或驗證工程師可以簡單地審查記錄的結果并簽字,以支持設備的cGMP放行。然后,廠商代表可以通過對軟件設置、分析人員培訓、向使用人員指出有用的功能和捷徑,如設置檢測模板、產品庫、驗證產品和用戶權限,將平臺整合到實驗室。有了如此多的支持,實驗室可以立即開始利用新平臺所帶來的優勢。
總體而言,驗證不一定是一項艱巨的任務。最終用戶可以選擇加快和簡化這一過程。當投資一個新的內毒素檢測平臺時,應考慮驗證過程。誰需要參與?通常需要多長時間?有更多支持選項嗎?實驗室最不愿意看到的是新的內毒素檢測平臺由于驗證的時間和復雜性,導致其無法將該平臺投入到日常使用中。
如今,制藥實驗室可以通過Sievers Eclipse月食細菌內毒素檢測平臺實現理想的驗證方案。該平臺可在短短幾天內完成驗證,分析人員可在這段時間內接受全面培訓,而且廠商會對USP <1225>和ICH Q2 (R1)中列出的所有七個指南記錄完整結果以對系統驗證進行支持。即使尚未將其投入到常規檢測中,QC實驗室也能立即看到此平臺帶來的好處。結合微流控自動化技術的優勢,用戶會意識到,直接的驗證、簡化的分析人員資格確認和快速的測定設置只是一個開始!

◆ ◆ ◆ 聯系我們,了解更多! 400 887 8280 sievers.china@veolia.com cn.sieversinstruments.com

-
廠商文章

-
廠商文章

-
廠商文章
-
廠商文章

-
廠商文章

-
廠商文章

-
廠商文章
-
廠商文章
-
廠商文章

-
廠商文章

-
廠商文章

-
廠商文章

-
廠商文章

-
廠商文章

-
廠商文章

-
廠商文章







